Professor Diminoi
TRANSFORMAÇÃOES GASOSAS
Gases são corpos muito especiais. São facilmente comprimidos ou expandidos. Além disso, as moléculas de corpos gasosos estão mais distantes e sempre mais agitadas do que nos sólidos e líquidos.
Um gás é caracterizado por três grandezas físicas: temperatura, volume e pressão. São as chamadas variáveis de estado, que definem o estado termodinâmico de um gás.
Para facilitar o estudo dos gases, os físicos adotam um modelo científico que trata o gás como um gás ideal.
Gás perfeito
Um gás perfeito, também chamado de gás ideal, é um conjunto de moléculas ou átomos que se movem constantemente e aleatoriamente. As moléculas não interagem entre si e as colisões entre elas são perfeitamente elásticas.
Características de um gás perfeito
- As moléculas se movem em movimento desordenado e rápido
- As velocidades médias das moléculas estão relacionadas com a temperatura
- As forças de coesão entre as moléculas são extremamente fracas
- O volume da molécula é desprezível quando comparado ao volume do gás
- Não há interação gravitacional entre as moléculas
- As colisões entre as moléculas são perfeitamente elásticas, ou seja, há total conservação da energia cinética
Variáveis de estado
As grandezas físicas temperatura (T), volume (V) e pressão (P) de um gás perfeito são o que chamamos de variáveis de estado, que, em conjunto, definem o comportamento macroscópico do gás.
Unidades correspondentes nas equações;
P = pressão (Pa)
V = volume (m³)
R = constante universal dos gases ideais (0,082 atm.l/mol.K ou 8,3 J/mol.K)
T1 = temperatura em Kelvin (K)
T2 = temperatura em Kelvin (K)
Vi = volume inicial volume (m³)
Vf = volume final volume (m³)
K = Não depende da natureza do gás. K = 1,38 . 10-23 J/K
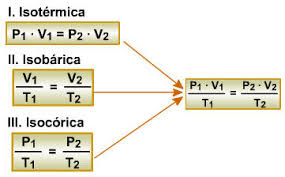
Transformação isotérmica ou A lei de Boyle-Mariotte
Ocorre quando a temperatura é constante, mas a pressão e o volume variam.
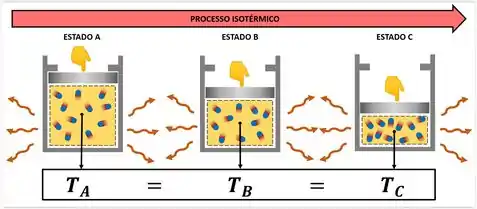
PV = K ou Pi .Vi = Pf . Vf
01) Certa quantidade de um gás ocupa um volume de 120 L em pressão de 700 mmHg e temperatura de 20 ºC. Qual será a pressão quando o volume for apenas de 30 L, mantendo-se a temperatura constante?
Resolução:
P1 . V1 = P2 . V2
P2 = P1 . V1
V2
P2 = 700 . 120
30
P2 = 2800 mmHg
02) (PUC-RJ) A cada 10 m de profundidade a pressão sobre um mergulhador aumenta 1 atm com relação à pressão atmosférica. Sabendo-se disso, qual seria o volume de 1 L de ar (comportando-se como um gás ideal) inspirado pelo mergulhador ao nível do mar, quando ele estivesse a 30 m de profundidade?
Resolução:
P1 . V1 = P2 . V2
1 atm . 1 L = 4 atm . V2
4V2 = 1
V2 = 1/4
V2 = 0,25 L = 250 mL
Transformação isobárica ou primeira lei de Charles/Gay-Lussac
Ocorre quando a pressão é constante, enquanto o volume e a temperatura variam. O trabalho na transformação isobárica.
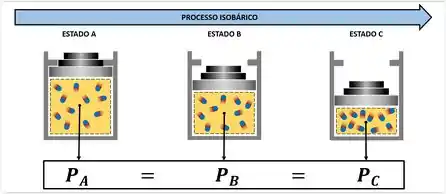
V = K ou Vi = Vf
T Ti Tf
03) Um gás no estado 1 apresenta volume de 14 L, pressão de 5 atm e temperatura de 300 K. Qual será o volume do gás em um estado 2 se a temperatura for dobrada à pressão constante?
Resolução:
V1 = V2
T1 T2
14 L /300 = 600/V2
300 . V2 = 14 . 600
V2 = 8400/300
V2 = 28 L
04) Em uma pressão constante, um gás é aquecido até que seu volume inicial de 150 L dobre. Se a temperatura inicial do gás era de 20ºC, qual deve ser a temperatura final na escala kelvin?
Resolução:
150 Tfinal = 300. 293
50 . Tfinal = 293 . 300
Tfinal = 87900/150
Tfinal = 586 K
Segunda lei de Charles/Gay-Lussac ou Transformação isovolumétrica ou isométrica ou ainda isocórica
Ocorre quando o volume é constante e sofre alteração de pressão e temperatura
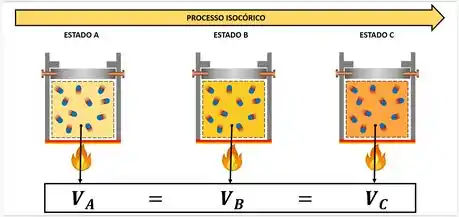
Pi = Pf
Ti Tf
05) Um gás no estado 1 apresenta volume de 14 L, pressão de 5 atm e temperatura de 300 K. Qual será a pressão do gás em um estado II se o volume permanecer igual a 14 L, mas a temperatura passar para 273 K?
Resolução:
Pinicial = Pfinal
Tinicial Tfinal
Pfinal = Pinicial . Tfinal
Tinicial
Pfinal = 5 atm . 273 K
300 K
Pfinal = 4,55 atm
06) (UEPG-PR) Um recipiente fechado de volume “V” contém certa massa gasosa à temperatura de 27°C, exercendo uma pressão de 760 mmHg. Após aquecimento, verificou-se que o novo valor da pressão era de 2 atm.

Supondo desprezível a variação de volume, a nova temperatura, em °C, do sistema será:
Resolução:
Pinicial = Pfinal
Tinicial Tfinal
Tfinal = Tinicial . Pfinal
Pinicial
Tfinal = 300 K . 2 atm
1 atm
Tfinal = 600 K = 600 – 273 = 327 ºC.
Lei Geral dos Gases
Quando uma certa massa de gás perfeito passa por uma transformação em que as três variáveis de estado – pressão (p), volume (V) e temperatura absoluta (T) – se alteram, podemos relacionar essas três variáveis por meio da Lei Geral dos Gases, dada pela seguinte expressão:
Pi . V1 = P2 . V2
T1 T2
05) Em um recipiente fechado, certa massa de gás ideal ocupa um volume de 12 litros a 293k. Se este gás for aquecido até 302k, sob pressão constante, seu volume será
Resolução:
V1 = V2
T1 T2
12 = V2
293 302
293 V2 = 12 . 302
293V2 = 6324
V2 = 3624
293
V2 = 12,37 L
07) (Uneb-BA) Em condições tais que um gás se comporta como ideal, as variáveis de estado assumem os valores 300 K, 2,0 m3 e 4,0 x 104 Pa, num estado A. Sofrendo certa transformação, o sistema chega ao estado B, em que os valores são 450 K, 3,0 m3 e p. O valor de p, em Pa, é:
Resolução:
Pi . V1 = P2 . V2
T1 T2
4 . 104 . 2 = pB . 3
300 450
8 . 104 = 3pB
300 450
3600 . 104 = 900pB
3600 . 104 = 900pB
pB = 4 . 104 pa
Equação de Clapeyron
Os resultados encontrados nas experiências podem ser explicados pela Equação de Clapeyron, que descreve a relação entre pressão, volume, número de partículas e temperatura, em um gás ideal.
P . V = n . R . T
08) Determine o volume molar de um gás ideal, cujas condições estejam normais, ou seja, a temperatura à 273K e a pressão a 1 atm. (Dado: R = 0,082 atm.L/mol.K)
Resolução:
pV = nRT
1.V = 1. 0,082. 273
V = 22,4 L
09) Determine o número de mols de um gás que ocupa volume de 90 litros. Este gás está a uma pressão de 2 atm e a uma temperatura de 100K. (Dado: R = 0,082 atm.L/mol.K)
Resolução:
pV = nRT
90 = n. 0,082. 100
180 = n. 8,2
n = 180/8,2
n = 21,95 mols
O trabalho na transformação isobárica:
τ = F . d
ou
τ = F . ΔV
10) Um cilindro contém 2 litros de um gás a uma temperatura de 27°C. Se o gás sofre uma transformação isobárica e a temperatura se eleva para 127°C, determine o volume final do gás.
Resolução:
V1 = V2
T1 T2
2 /300,15 = 400 V2
V2 . 300,15 = 2 . 400,15
V2 300,15 = 800,3
V2 = 800,3/300,15
V2 = 2,6
11) Em uma transformação isobárica um gás que preenche um recipiente de 3,0 l e está inicialmente com uma temperatura de 450 K. O estado final do gás indica que sua temperatura diminuiu para 300 K. Qual o volume do gás ao término da transformação?
Resolução:
V1 = V2
T1 T2
3,01/400 = 300
450V2 = 3,01 . 300
450V2 = 903
V2 = 903/450
V2 = 2,0
Sinais da variação da energia interna (ΔU).
Variação da energia interna do gás positiva (ΔU > 0), o gás terá recebido energia.
Variação da energia interna do gás negativa (ΔU< 0), o gás cede parte de sua energia.
EXERCÍCIOS GERAIS
01) Observe o gráfico abaixo:
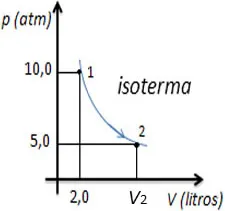
A isoterma de uma quantidade de gás que é levado de um estado 1 para um estado 2. O volume do estado 2, em litros, é:
Resolução:
P1 . v1 = P2 . V2
10 . 2 = p2 . V2
20 = 5V2
20/5 = V2
V2 = 4L
02) (PUC-SP) Um certo gás, cuja massa vale 140g, ocupa um volume de 41 litros, sob pressão 2,9 atmosferas a temperatura de 17°C. O número de Avogadro vale 6,02. 1023 e a constante universal dos gases perfeitos R= 0,082 atm.L/mol.K. Nessas condições, o número de moléculas continuadas no gás é aproximadamente de:
Resolução:
pV = nRT
2,9. 41 = n. 0,082. 290
n = 5 mols
Usaremos regra de três simples para calcularmos o valor das moléculas
1 mol _______ 6,02 .1023 moléculas
5 mols ______ x
x ≈ 3,00. 1024 moléculas (note que este é um valor aproximado: houve a utilização da regra de arredondamento.)
03) Com base nas características de um gás ideal, analise as afirmações a seguir:
I. As partículas de um gás ideal ocupam um volume desprezível em relação ao volume total do recipiente.
II. As forças de atração e repulsão entre as partículas de um gás ideal são consideradas nulas, exceto durante as colisões.
III. As colisões entre as partículas de um gás ideal e as paredes do recipiente são inelásticas, resultando em perda de energia cinética.
IV. As partículas de um gás ideal movem-se em trajetórias retilíneas e uniformes entre as colisões.
(A) Apenas as afirmativas I e II estão corretas.
(B) Apenas as afirmativas II e III estão corretas.
(C) Apenas as afirmativas I, II e IV estão corretas.
(D) Todas as afirmativas estão corretas.
(E) Nenhuma das afirmativas está correta
Resolução:
Afirmativa I: Correta. A característica de "partículas pontuais" significa que o volume ocupado pelas próprias partículas é considerado desprezível em relação ao volume total do recipiente.
Afirmativa II: Correta. A ausência de interações intermoleculares, exceto durante colisões elásticas, é uma característica fundamental dos gases ideais.
Afirmativa III: Incorreta. As colisões em um gás ideal são perfeitamente elásticas, ou seja, não há perda de energia cinética durante as colisões.
Afirmativa IV: Correta. Entre as colisões, as partículas de um gás ideal movem-se em linha reta e com velocidade constante, devido à ausência de forças atuando sobre elas.
Alternativa: C
04) A equação de estado dos gases perfeitos, PV = nRT, relaciona diversas grandezas que descrevem o comportamento de um gás ideal. Considerando essa equação e os conceitos relacionados aos gases perfeitos, assinale a alternativa incorreta:
(A) Aumentando a temperatura de um gás ideal a volume constante, a pressão também aumenta.
(B) Diminuindo o volume de um gás ideal a temperatura constante, a pressão aumenta.
(C) A constante universal dos gases perfeitos (R) tem o mesmo valor para todos os gases ideais.
(D) A equação de estado dos gases perfeitos é válida para qualquer gás, independentemente das condições de pressão e temperatura.
(E) O número de mols (n) de um gás é diretamente proporcional ao volume ocupado por ele, a pressão e a temperatura constantes.
Resolução:
Alternativa b) Correta: A lei de Boyle estabelece que o produto da pressão pelo volume de um gás ideal é constante, a temperatura constante. Portanto, ao diminuir o volume, a pressão aumenta para manter o produto constante.
Alternativa c) Correta: A constante universal dos gases perfeitos é uma constante física que tem o mesmo valor para todos os gases ideais.
Alternativa d) Incorreta: A equação de estado dos gases perfeitos é uma idealização e não descreve o comportamento de todos os gases em todas as condições. A altas pressões e baixas temperaturas, as interações intermoleculares se tornam significativas e o modelo do gás perfeito se torna menos preciso.
Alternativa e) Correta: A lei de Avogadro estabelece que volumes iguais de gases diferentes, nas mesmas condições de temperatura e pressão, contêm o mesmo número 1 de moléculas. Portanto, o número de mols é diretamente proporcional ao volume, a pressão e a temperatura constantes.
Alternativa: D
05) Analise as afirmações a seguir, que tratam das transformações gasosas isotérmica, isocórica e adiabática, e marque V para as alternativas verdadeiras e F para as alternativas falsas.
I. Em uma transformação isotérmica, a temperatura do gás permanece constante, mas sua pressão e volume podem variar.
II. Em uma transformação isocórica, o volume do gás permanece constante, o que implica que não há trabalho realizado pelo gás ou sobre ele.
III. Durante uma transformação adiabática, ocorre troca de calor entre o gás e o ambiente, mas a temperatura do gás não varia.
IV. Na transformação isotérmica, o trabalho realizado pelo gás é igual à variação de sua energia interna.
V. Em uma transformação adiabática, o calor trocado com o meio é zero, mas a energia interna pode variar devido à realização de trabalho.
(A) V, V, F, F, V
(B) F, F, F, F, V
(C) V, V, V, V, V
(D) V, V, F, F, V
(E) V, V, V, F, V
Resolução:
I. V – Na transformação isotérmica, a temperatura é constante, mas a pressão e o volume podem variar conforme a equação P vezes V igual a c o n s t a n t e
IIV – Na transformação isocórica, o volume é constante, e, portanto, W=0 (não há trabalho realizado).
III. F – Em uma transformação adiabática, não há troca de calor com o ambiente (Q=0), mas a temperatura pode variar devido à compressão ou expansão do gás.
IV. F – Na isotérmica, a variação de energia interna é zero (ΔU=0), e o trabalho realizado pelo gás é igual ao calor trocado (Q=W).
V. V – Na transformação adiabática, o calor trocado é zero (Q=0), mas a energia interna pode variar em função do trabalho realizado pelo gás ou sobre ele.
Alternativa: D
06) Uma massa gasosa está confinada em um recipiente com volume inicial de 8,0 L, a uma temperatura de 300 K e submetida a uma pressão inicial de 2,0 atm. O gás sofre uma transformação onde a pressão é aumentada para 3,0 atm e o volume diminui para 6,0 L.
Com base nesses dados, a nova temperatura do gás após e a transformação são
(A) 225,5 k e a transformação Isotérmica.
(B) 270,5 k e a transformação Isocórica
(C) 337,5 k e a transformação Geral dos gases (sem condição restritiva específica)
(D) 362,5 k e a transformação Adiabática
(E) 432,5 k e a transformação Isobárica
Resolução:
Usar a equação geral dos gases para calcular a nova temperatura.
A equação geral dos gases é:
Pi . V1 = P2 . V2
T1 T2
2 . 8/300 = 3 . 6T2
16/300 = 18T2
16T2 = 18 . 300
16T2 = 5400
T2 = 5400/16
T2 = 377,5
Alternativa: C
07) Analise as alternativas abaixo e assinale a resposta que contém somente alternativas verdadeiras.
I – Transformações isotérmicas são aquelas em que a temperatura do gás é mantida constante.
II – Transformações adiabáticas envolvem trocas de calor entre o gás e o meio externo.
III – Transformação isocórica é aquela em que a pressão do gás é mantida constante.
IV – Transformações isobáricas acontecem com pressão constante.
São corretas:
(A) I e II.
(B) I, II e III.
(C) II e III.
(D) I e IV.
Resolução:
As alternativas II e III estão erradas, uma vez que as transformações adiabáticas não envolvem trocas de calor, e as transformações isocóricas são aquelas que acontecem em volumes constantes.
Alternativa: D
08) Um gás ideal sofre uma transformação rápida, de modo que sua temperatura, pressão e volume sofrem variações bruscas em um curto intervalo de tempo. De acordo com os seus conhecimentos sobre as transformações gasosas, a transformação sofrida pelo gás foi:
(A) isotérmica.
(B) isobárica.
(C) adiabática.
(D) isovolumétrica.
Resolução:
As transformações adiabáticas ocorrem de forma rápida, de modo que não há tempo para que o gás realize trocas de calor com o meio externo. Nesse tipo de transformação, os parâmetros de pressão, volume e temperatura mudam de forma abrupta.
Alternativa: C
08) Vinte litros de gás hidrogênio foram medidos a 27ºC e 700 mmHg de pressão. Qual será o novo volume do gás a 87ºC e 600 mmHg de pressão?
Resolução:
P1 . V1 =P2 . V2
T1 T2
V2 = P1 . V1 . T2
P2 . T1
V2 = 700 . 20 . 360
600 . 300
V2 = 28 L
09) Foram medidos 38 L de cloro a 127 ºC e a 720 mmHg de pressão. Qual será o volume que esse gás ocupará se ele for reduzido às condições normais de temperatura e pressão (CNTP)?
Resolução:
P1 . V1 = P 2. V2
T1 T2
V2 = P1.V1 . T2
P2. T1
V2 = 720 . 38 . 273
760 . 400
V2 = 24,57 L
10) (Cesgranrio-RJ) Você brincou de encher, com ar, um balão de gás, na beira da praia, até um volume de 1 L e o fechou. Em seguida, subiu uma encosta próxima carregando o balão, até uma altitude de 900m, onde a pressão atmosférica é 10% menor que a pressão ao nível do mar. Considerando que a temperatura na praia e na encosta seja mesma, o volume de ar no balão após a subida, será de:
Resolução:
P1.V1 = P2.V2
P1. 1 = (0,90 . P1) . V2
V2 = 1 P1
(0,90 . P1)
V2 = 1
0,90
V2 = 1,1L
11) (UFU-MG) A atmosfera é composta por uma camada de gases que se situa sobre a superfície da Terra. Imediatamente acima do solo localiza-se uma região da atmosfera conhecida por troposfera, na qual ocorrem as nuvens, os ventos e a chuva. Ela tem uma altura aproximada de 10 km, a temperatura do seu topo é cerca de -50 °C e sua pressão é de 0,25 atm. Se um balão resistente a altas pressões, cheio com gás hélio até um volume de 10 L, a 1,00 atm e 27 °C, for solto, o volume deste balão, quando chegar ao topo da troposfera, será de:
Resolução:
P1 . V1 = P 2. V2
T1 T2
V2 = P1.V1 . T2
P2. T1
V2 = 1,00 . 10 . 223
0,25 . 300
V2 = 29,7 L
12) Um gás ideal ocupa 6 litros em um recipiente, a pressão dentro do frasco é de 3 atm. Suponha que o gás sofra uma expansão isotérmica e passe a ocupar 9 litros. Qual será a pressão dentro do frasco?
Resolução:
P1V1 = P2V2
3 . 6 = P2 . 9
18 = 9P2
P2 = 18/2
P2 = 2 atm
13) Considerando a pressão de um gás ideal constante, o volume ocupado por ele é de 3 litros e a temperatura varia de 400 K para 800 K. Qual o volume final que este gás ocupa no frasco?
Resolução:
P1V1 = P2V2
3/400 = V2/800
400V2 = 3 . 800
400V2 = 2400
V2 = 2400/400
V2 = 6 litros





